Ponto De Fusão E Ebulição Exemplos são conceitos fundamentais na química que descrevem as temperaturas nas quais uma substância muda de estado físico. O ponto de fusão é a temperatura em que um sólido se transforma em líquido, enquanto o ponto de ebulição é a temperatura em que um líquido se transforma em gás.
Esses pontos são influenciados por uma série de fatores, incluindo a pressão atmosférica, a força das ligações intermoleculares e a massa molecular da substância.
Compreender os pontos de fusão e ebulição é essencial para diversas áreas, como a indústria química, a produção de alimentos e a fabricação de medicamentos. Por exemplo, o ponto de ebulição da água é utilizado para a purificação de substâncias através da destilação, enquanto o ponto de fusão do chocolate é crucial para a sua fabricação e processamento.
Conceitos Fundamentais
O ponto de fusão e o ponto de ebulição são propriedades físicas importantes que caracterizam a matéria. Eles representam as temperaturas específicas em que uma substância muda de estado físico, sob pressão constante.
Diferença entre Ponto de Fusão e Ponto de Ebulição
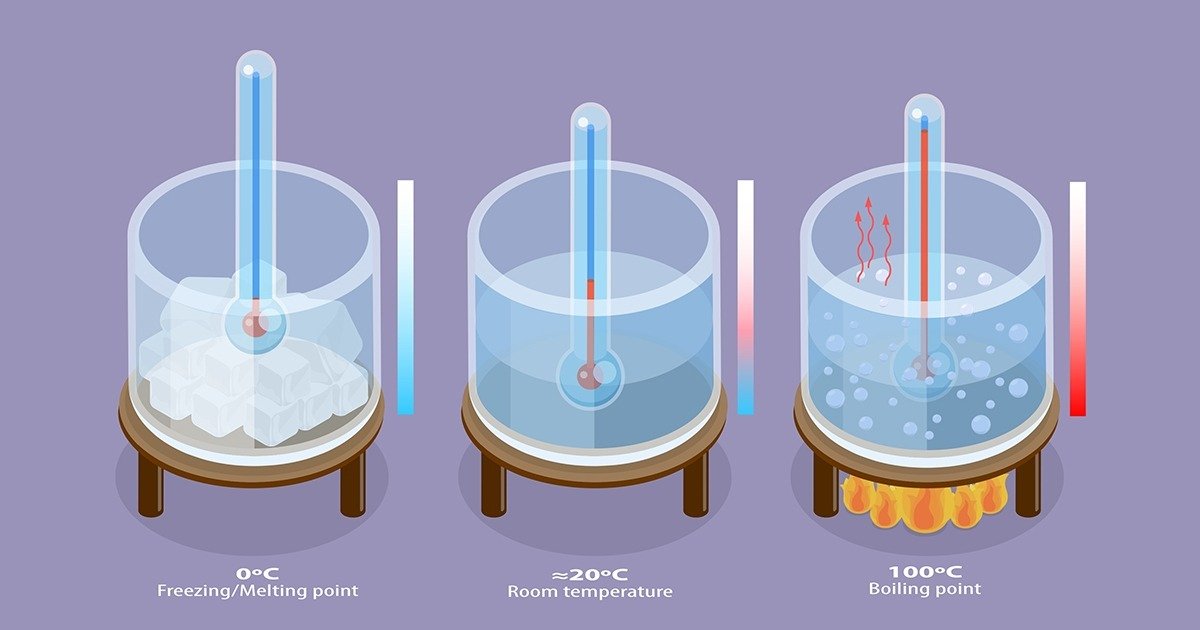
O ponto de fusão é a temperatura em que uma substância sólida passa para o estado líquido, enquanto o ponto de ebulição é a temperatura em que um líquido passa para o estado gasoso.
Mudanças de Estado Físico
Fusão
No ponto de fusão, a energia cinética das moléculas aumenta, superando as forças intermoleculares que mantêm as moléculas em uma estrutura rígida. As moléculas, então, adquirem maior liberdade de movimento, passando do estado sólido para o estado líquido.
Ebulição
No ponto de ebulição, a pressão de vapor do líquido se iguala à pressão atmosférica, permitindo que as moléculas escapem da superfície do líquido e entrem na fase gasosa.
Forças Intermoleculares e Ponto de Fusão e Ebulição
As forças intermoleculares são as forças de atração entre as moléculas. Elas influenciam diretamente o ponto de fusão e ebulição de uma substância. Quanto mais fortes as forças intermoleculares, maior a energia necessária para romper as ligações entre as moléculas, resultando em pontos de fusão e ebulição mais altos.
- Forças de Van der Waals:São forças intermoleculares relativamente fracas que ocorrem devido a flutuações temporárias na distribuição de elétrons em moléculas. Essas forças são mais fortes em moléculas maiores e mais polares.
- Ligações de Hidrogênio:São forças intermoleculares fortes que ocorrem entre moléculas que possuem átomos de hidrogênio ligados a átomos pequenos e eletronegativos, como oxigênio, nitrogênio ou flúor. Essas ligações são responsáveis pelos altos pontos de ebulição da água, por exemplo.
- Forças dipolo-dipolo:São forças intermoleculares que ocorrem entre moléculas polares, devido à atração entre os polos positivos e negativos das moléculas. Essas forças são mais fortes do que as forças de Van der Waals, mas mais fracas do que as ligações de hidrogênio.
Ponto de Fusão e Ebulição de Substâncias com Diferentes Tipos de Ligações Químicas
O tipo de ligação química presente em uma substância também influencia o seu ponto de fusão e ebulição.
- Ligações Iônicas:As ligações iônicas são fortes e requerem muita energia para serem quebradas. As substâncias iônicas, portanto, têm pontos de fusão e ebulição altos.
- Ligações Covalentes:As ligações covalentes são mais fracas do que as ligações iônicas. As substâncias covalentes, portanto, têm pontos de fusão e ebulição mais baixos. As ligações covalentes podem ser polares ou apolares, o que também afeta o ponto de fusão e ebulição.
- Ligações Metálicas:As ligações metálicas são fortes e são responsáveis pelas propriedades únicas dos metais, como a condutividade elétrica e térmica. Os metais têm pontos de fusão e ebulição relativamente altos.
Fatores que Influenciam o Ponto de Fusão e Ebulição: Ponto De Fusão E Ebulição Exemplos
O ponto de fusão e o ponto de ebulição são propriedades físicas importantes que descrevem a temperatura na qual uma substância muda de estado físico. Essas temperaturas são influenciadas por diversos fatores, que determinam a força das interações intermoleculares entre as moléculas da substância.
Influência da Pressão Atmosférica
A pressão atmosférica é um fator que influencia diretamente o ponto de ebulição de uma substância. A pressão atmosférica é a força exercida pelo ar atmosférico sobre uma superfície. Quanto maior a altitude, menor a pressão atmosférica.
Em altitudes mais elevadas, a pressão atmosférica é menor, o que significa que as moléculas da substância precisam vencer uma menor força para escapar do líquido e entrar na fase gasosa. Consequentemente, o ponto de ebulição da substância diminui.
Por exemplo, a água ferve a 100 °C ao nível do mar, mas em altitudes mais elevadas, como o topo de uma montanha, a água ferve a uma temperatura menor.
Comparação de Substâncias com Diferentes Massas Moleculares
A massa molecular de uma substância também influencia o ponto de fusão e o ponto de ebulição. Quanto maior a massa molecular, maiores as forças de atração intermoleculares entre as moléculas, o que requer mais energia para romper essas ligações e mudar o estado físico da substância.
Substâncias com massas moleculares maiores geralmente possuem pontos de fusão e ebulição mais altos.
Por exemplo, o metano (CH4) tem uma massa molecular menor que o etano (C2H6). O metano tem um ponto de ebulição de
- 161,5 °C, enquanto o etano tem um ponto de ebulição de
- 88,6 °C.
Influência da Polaridade das Moléculas
A polaridade das moléculas também afeta o ponto de fusão e o ponto de ebulição. Moléculas polares possuem uma distribuição desigual de elétrons, o que resulta em um momento dipolar permanente. As forças intermoleculares entre moléculas polares, como as ligações de hidrogênio, são mais fortes do que as forças de Van der Waals que atuam entre moléculas apolares.
Substâncias com moléculas polares geralmente possuem pontos de fusão e ebulição mais altos do que substâncias com moléculas apolares de massa molecular semelhante.
Por exemplo, a água (H2O) é uma molécula polar e tem um ponto de ebulição de 100 °C, enquanto o metano (CH4) é uma molécula apolar e tem um ponto de ebulição de
161,5 °C.
Fatores que Influenciam o Ponto de Fusão e Ebulição
| Fator | Ponto de Fusão | Ponto de Ebulição |
|---|---|---|
| Forças intermoleculares | Quanto mais fortes as forças intermoleculares, maior o ponto de fusão. | Quanto mais fortes as forças intermoleculares, maior o ponto de ebulição. |
| Massa molecular | Quanto maior a massa molecular, maior o ponto de fusão. | Quanto maior a massa molecular, maior o ponto de ebulição. |
| Polaridade das moléculas | Quanto mais polar a molécula, maior o ponto de fusão. | Quanto mais polar a molécula, maior o ponto de ebulição. |
| Pressão atmosférica | Não afeta significativamente o ponto de fusão. | Quanto menor a pressão atmosférica, menor o ponto de ebulição. |
| Forma da molécula | Moléculas com formas mais compactas tendem a ter pontos de fusão mais altos. | Moléculas com formas mais compactas tendem a ter pontos de ebulição mais altos. |
| Ligações de hidrogênio | Presença de ligações de hidrogênio aumenta o ponto de fusão. | Presença de ligações de hidrogênio aumenta o ponto de ebulição. |
Aplicações Práticas
O ponto de fusão e o ponto de ebulição são propriedades físicas importantes que possuem diversas aplicações práticas em vários campos, desde a indústria até a vida cotidiana.
Purificação de Substâncias
A diferença no ponto de ebulição entre os componentes de uma mistura pode ser utilizada para separá-los. Este processo é conhecido como destilação. Na destilação, a mistura é aquecida até que o componente com o ponto de ebulição mais baixo vaporize.
O vapor é então condensado e coletado separadamente, deixando o componente com o ponto de ebulição mais alto na mistura original.
Indústria de Alimentos
O ponto de fusão e o ponto de ebulição desempenham papéis cruciais na indústria de alimentos, influenciando a textura, a aparência e o sabor dos alimentos.
- O ponto de fusão da manteiga, por exemplo, determina a sua temperatura de derretimento, influenciando o seu uso em receitas.
- O ponto de ebulição da água é crucial para o cozimento, pois determina a temperatura necessária para cozinhar alimentos.
- O ponto de fusão do chocolate é importante para a sua moldagem e textura.
Produção de Medicamentos
O ponto de fusão e o ponto de ebulição são propriedades importantes na produção de medicamentos, pois influenciam a sua pureza, estabilidade e forma de administração.
- O ponto de fusão de um medicamento determina a temperatura em que ele derrete, o que pode afetar a sua estabilidade e a sua forma de administração.
- O ponto de ebulição de um medicamento é importante para a sua purificação e para a sua formulação em diferentes formas de dosagem, como soluções injetáveis.
Em resumo, o ponto de fusão e o ponto de ebulição são propriedades importantes que definem o comportamento físico das substâncias. A compreensão desses conceitos é fundamental para diversas áreas, desde a química básica até a indústria e a pesquisa científica.
A influência de fatores como a pressão atmosférica, as forças intermoleculares e a massa molecular permite a manipulação e o controle do comportamento das substâncias, abrindo portas para novas descobertas e aplicações práticas.

